Effect of miR-340-5p on proliferation of laryngeal cancer Hep2 cells and its intrinsic molecular mechanism
-
摘要: 目的 研究miR-340-5p对喉癌Hep2细胞增殖的影响并探究其内在分子机制,为喉癌的诊断和治疗筛选潜在的生物标志物及靶点。方法 利用qRT-PCR对喉癌患者癌组织、癌旁组织、喉癌细胞株Hep2和正常支气管HBE细胞株中miR-340-5p表达进行定量分析;通过构建双荧光素酶报告载体验证STAT3是否为miR-340-5p潜在靶基因;利用脂质体转染miR-340-5p mimics/inhibitor于Hep2细胞中并通过qRT-PCR进行验证;分别利用CCK-8法、Annexin V/PI法对转染后的细胞进行细胞增殖、凋亡分析;利用Western Blot检测转染后STAT3及Wnt/β-catenin通路相关蛋白表达量。结果 qRT-PCR结果表明喉癌组织及Hep2细胞中miR-340-5p水平显著低于癌旁组织及HBE细胞,且过表达或抑制miR-340-5p后其表达量分别显著提高或降低;荧光素酶活性表明miR-340-5p直接与靶基因STAT3 3’-UTR相互作用,负调控其表达;细胞增殖、凋亡分析表明上调miR-340-5p可显著抑制Hep2细胞体外增殖并诱导其凋亡,反之亦然;Western Blot结果表明过表达miR-340-5p后Hep2细胞内STAT3及β-catenin、c-Myc、TCF-4、CyclinD1和ROCK1蛋白水平较对照组显著降低,反之亦然。结论 miR-340-5p在喉癌组织及Hep2细胞中异常低表达,其通过靶向STAT3基因负调控Wnt/β-catenin信号通路抑制喉癌病程,因此可作为喉癌诊断、治疗潜在生物学靶标。
-
关键词:
- miR-340-5p /
- 喉肿瘤 /
- Hep2细胞 /
- 细胞增殖 /
- STAT3
Abstract: Objective To study the effect of miR-340-5p on the proliferation of laryngeal cancer Hep2 cells and explore its intrinsic molecular mechanism, so as to screen potential biomarkers and targets for the diagnosis and treatment of laryngeal cancer.Method The expression of miR-340-5p in laryngeal cancer tissues, paracancerous tissues, laryngeal cancer cell lines Hep2 and normal bronchial HBE cell lines was quantitatively analyzed by qRT-PCR; The double luciferase reporter vector was constructed to verify whether STAT3 was a potential target gene of microRNA-340-5p; The miR-340-5p mimics/inhibitor was transfected into Hep2 cells by liposome and verified by qRT-PCR; The CCK-8 method and Annexin V/PI method were used to analyze the proliferation and apoptosis of transfected cells; and Western Blot was used to detect the expression of STAT3 and Wnt/β-catenin pathway-related proteins after transfection.Result The results of qRT-PCR showed that the level of miR-340-5p in laryngeal cancer tissues and Hep2 cells was significantly lower than that in adjacent tissues and HBE cells, and the expression of miR-340-5p was significantly increased or decreased after overexpression or inhibition; Luciferase activity showed that miR-340-5p directly interacted with target gene STAT3 3'-UTR and negatively regulated its expression; Cell proliferation and apoptosis analysis showed that up-regulation of microRNA-340-5p could significantly inhibit the proliferation and induce apoptosis of Hep2 cells in vitro, and vice versa; Western Blot results showed that the levels of STAT3 and β-catenin, c-Myc, TCF-4, CyclinD1 and ROCK1 in Hep2 cells were significantly lower than those in the control group after over-expression of miR-340-5p, and vice versa.Conclusion The expression of miR-340-5p is abnormally low in laryngeal cancer tissues and Hep2 cells. It can be used as a potential biological target for diagnosis and treatment of laryngeal cancer by targeting STAT3 gene to negatively regulate Wnt/β-catenin signaling pathway.-
Key words:
- miR-340-5p /
- laryngeal neoplasms /
- Hep2 cells /
- cell proliferation /
- STAT3
-
喉癌是目前较为常见的发生在头颈部的恶性肿瘤,其中喉鳞状细胞癌是最为典型的类型之一〔1〕。根据喉癌的原发部位不同,可将其分为声门上型喉癌、声门型喉癌和声门下型喉癌〔2〕。近几年来,环境污染、不健康的生活方式等因素,导致喉癌的发病率和死亡率逐年递增〔3〕。目前喉癌的治疗方式有手术和保守治疗(包括放疗、诱导化疗和靶向治疗等)2种常用方法〔4〕,因此深入研究喉鳞状细胞癌变分子机制将为改良抗癌疗法提供新视角。
小RNA(miRNAs)分子是一种长约22nt的非编码RNA,研究表明其通过与靶基因3'-UTR互补配对从而在转录后水平上调控靶mRNA表达〔5〕。研究发现miRNAs可以作为原癌基因或抑癌基因调节肿瘤细胞的增殖、迁移、侵袭和凋亡等过程,从而达到抑制肿瘤细胞增生和再次病变的作用〔6〕。miR-340-5p在多种癌细胞中异常表达,表明其在多种癌症中发挥作用,但其促癌或抑癌效应似乎取决于癌症种类,如miR-340-5p在B型肝炎病毒相关的肝癌中可抑制癌细胞增殖和迁移〔7〕,但在甲状腺癌中表达上调并促进其病程发展〔8〕,其往往通过与靶基因作用调控信号通路活性从而调控多种癌基因的表达。研究表明喉鳞状细胞癌病理与多种miRNAs相关〔9〕,但miR-340-5p在喉癌发生发展中的作用笔者尚未见报道。
本研究旨在探究miR-340-5p表达与喉癌病理的关系,以及其如何通过与靶基因相互作用调控Wnt/β-catenin信号通路进而影响Hep2细胞增殖及凋亡,从而为筛选喉癌潜在的诊断和治疗生物靶标提供理论依据。
1. 材料与方法
1.1 材料
1.1.1 研究样本
40例喉癌组织标本均来自于2013-01-2018-01在新疆维吾尔自治区人民医院住院接受治疗的喉癌患者,均采用外科治疗,患者此前未接受放疗和化疗等任何治疗方式,喉癌样本均经过3名组织病理学家验证。男女性患者分别为22例和18例。所有标本切除后,取部分肿瘤组织,迅速放入液氮,再转入—80℃冰箱保存备用。所有采集过程及后续研究均得到知情者同意以及医学伦理委员会批准(审批号:20130214-016),且为患者签署保密协议。
1.1.2 主要试剂
喉鳞状细胞癌细胞株Hep2和正常支气管细胞株HBE(中科院上海生命科学研究院生物化学与细胞生物研究所);DMEM培养液、胎牛血清(Gibco,美国);TRIzol Reagent、Prime Script® RT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM II(宝生物,大连);pMIR-REPORT荧光素酶报告载体(Applied Biosystems,美国);双荧光素酶分析试剂盒(Promega,Madison,美国);QuickChange Lighting Mutagenesis Kit(Stratagene,美国);miR-340-5p mimics/inhibitor及阴性对照的合成(吉玛公司,上海);Lipofectamine 3000(Invitrogen,美国);CCK-8(Dojindo,日本);Annexin V-FITC细胞凋亡分析试剂盒(eBioscience,美国);兔/鼠抗人STAT3、β-catenin、c-Myc、TCF-4、CyclinD1、ROCK1和β-actin单克隆抗体、HRP抗兔/鼠IgG二抗(CST,美国);引物(上海生工生物工程有限公司)等。
1.2 方法
1.2.1 细胞培养及转染
将Hep2和HBE细胞株用DMEM培养液(10%FBS+1%青链双抗),于37℃、5% CO2培养箱中培养,转染前1 d将生长于对数期的Hep2细胞接种于96孔板中并保持细胞密度为1×105个/孔,待细胞汇合度达到40%~50%时,用Lipofectamine 3000转染试剂将20 nmol/L NC mimics和miR-340-5p mimics或者20 nmol/L NC inhibitor和miR-340-5p inhibitor转染入Hep2细胞中,同时设置对照组(加入等量DMEM培养液和脂质体试剂混合液),转染48 h后,收集细胞用于后续实验。
1.2.2 qRT-PCR
利用TRIzol试剂提取组织或细胞总RNA,利用Prime Script® RT reagent Kit with gDNA Eraser试剂盒进行cDNA合成,反应条件为37℃孵育15 min后85℃加热5 s并于4℃保存,利用SYBR®Premix Ex TaqTM II进行qRT-PCR反应,反应条件为95℃ 30 s、95℃ 5 s、60℃ 30 s(40循环)后溶解曲线步骤,应用CFX-96 Real-Time PCR Detection System(伯乐,美国)进行检测,扩增结束后收集数据并用比较循环阈值法处理,miR-340-5p的引物为Bulge-LoopTM miRNA RT-PCR引物,以U6 snRNA为miRNA定量内参,β-actin为mRNA内参,引物序列见表 1。
表 1 qRT-PCR及质粒构建引物序列Primer Sequence(5'-3') STAT3-qF GGCCCAATGGAATCAGCTACAG STAT3-qR GAAGAAACTGCTTGATTCTTCG ACTB-F AGTCCTGTGGCATCCACGAAA ACTB-R GTCATACTCCTGCTTGCTGA STAT3-3' UTR-F ATCCGCTCGAGATGGCCCAATGGAATC STAT3-3' UTR-R CGACGCGTGAGGTCAACTCCATGTCAAAG 1.2.3 荧光素酶报告基因分析
扩增STAT3的3'-UTR,此区域有潜在的miR-340-5p结合位点,将扩增产物胶回收后连接至XhoI和MluI双酶切的pMIR-REPORT荧光素酶报告载体形成pMIR-REPORT-WT并测序鉴定;随后将测序正确后的重组质粒用点突变试剂盒进行STAT3的3’-UTR定点突变形成pMIR-REPORT-MUT,质粒构建引物序列见表 1。将miR-340-5p mimics或其NC mimics和pMIR-REPORT-WT或pMIR-REPORT-MUT分别共转染至Hep2细胞内,48 h或72 h后收集细胞,参照双荧光素酶分析试剂盒进行荧光素酶活性分析,以海肾荧光素酶为内对照。
1.2.4 细胞增殖分析
取各组转染48 h后的细胞以每孔2×103个细胞接种于含有DMEM和10% FBS培养液的96孔板中培养,每隔1 d加入10 μL的CCK-8试剂于37℃黑暗条件下孵育3 h,以450 nm为波长测定各孔吸光值,细胞活性以起始点进行标准化并以百分数表示。
1.2.5 细胞凋亡分析
参照细胞凋亡分析试剂盒,对转染48 h后的细胞进行Annexin V-FITC/PI双染色,于流式细胞仪(BD Biosciences,美国)中分析早晚期细胞凋亡率。
1.2.6 Western Blot分析
收集转染72 h后的细胞并用RIPA裂解提取总蛋白并定量,取等量60 μg蛋白于SDS-PAG分离并电转印于PVDF膜上,随后于含有5%脱脂牛奶的TBST中室温封闭1 h后用STAT3、β-catenin、c-Myc、TCF-4、CyclinD1、ROCK1和β-actin一抗(1∶1 000)4℃孵育过夜,第2天用TBST洗膜3次并用HRP二抗(1∶5 000)室温孵育2 h,TBST洗净后用ECL检测系统(Thermo Fisher Scientific,Waltham,MA,USA)显影条带,并于ImageJ软件(National Institutes of Health,Bethesda,MD,USA)计算条带灰度值,目的蛋白/β-actin灰度值为蛋白水平。
1.3 统计学分析
利用SPSS 17.0软件进行统计学分析,所有实验均重复3次且数据以x±s表示,2组间比较利用双尾t值检验,多组间进行单因素方差分析,P<0.05为差异有统计学意义。
2. 结果
2.1 miR-340-5p在喉癌组织及细胞中的表达情况
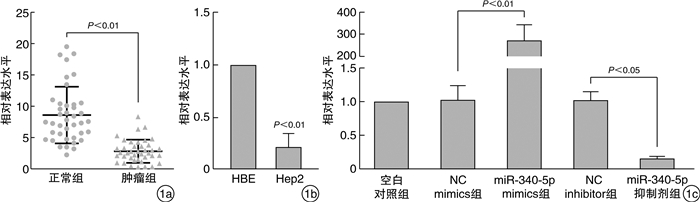
通过qRT-PCR检测喉癌患者癌组织及癌旁组织,Hep2及HBE细胞中miR-340-5p表达水平。结果如图 1a、b所示:与正常癌旁组织相比,miR-340-5p在喉癌患者癌组织中异常显著低表达;Hep2细胞中miR-340-5p表达水平显著低于HBE细胞。
为进一步探究miR-340-5p与喉癌病理机制的关系,我们分别在Hep2细胞中转染miR-340-5p mimics与inhibitor及其阴性对照并通过qRT-PCR定量miR-340-5p表达,结果如图 1c所示:过表达miR-340-5p后其水平较NC mimics组显著升高,而抑制miR-340-5p后其水平较NC inhibitor组显著降低。
2.2 miR-340-5p与其潜在靶基因STAT3的调控关系
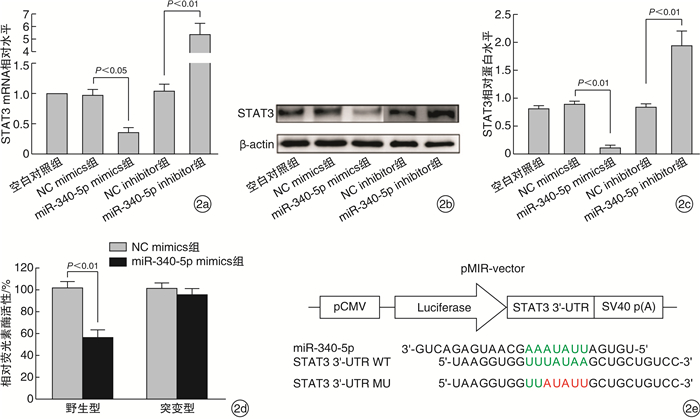
通过TargetScan预测STAT3是miR-340-5p的潜在靶基因并采用qRT-PCR和Western Blot检测过表达和抑制miR-340-5p后Hep2细胞内STAT3 mRNA和蛋白水平。过表达miR-340-5p后STAT3 mRNA和蛋白表达量较NC mimics显著降低,而抑制miR-340-5p表达后STAT3 mRNA和蛋白水平相比于NC inhibitor显著升高,见图 2a~c。
此外,为验证miR-340-5p直接与STAT3的3'-UTR结合并调控其表达,构建双荧光素酶报告载体并与mimics或其NC mimics共转染至Hep2细胞中分析萤火虫荧光素酶的相对活性,结果见图 2d,与NC mimics相比,过表达miR-340-5p可显著降低荧光素酶活性,而对STAT3 3'-UTR进行定点突变后(图 2e),这种抑制效应明显减弱,且较NC mimics无变化。双荧光素酶报告分析结果表明:miR-340-5p可与其靶基因STAT3的3’-UTR互补配对而负调控其表达。
2.3 miR-340-5p对Hep2细胞体外增殖的影响
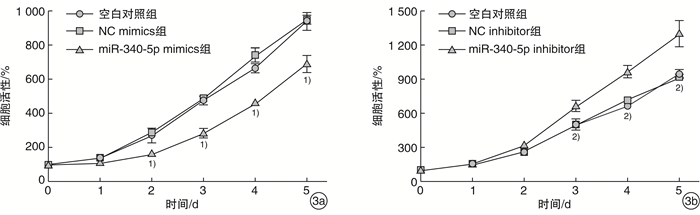
通过CCK-8法分析miR-340-5p mimics/inhibitor转染Hep2细胞后,细胞的增殖情况,过表达miR-340-5p与NC mimics相比细胞增殖显著受到抑制,而抑制miR-340-5p表达相比于NC inhibitor可显著促进细胞增殖。见图 3。
2.4 miR-340-5p对喉癌癌细胞凋亡的影响
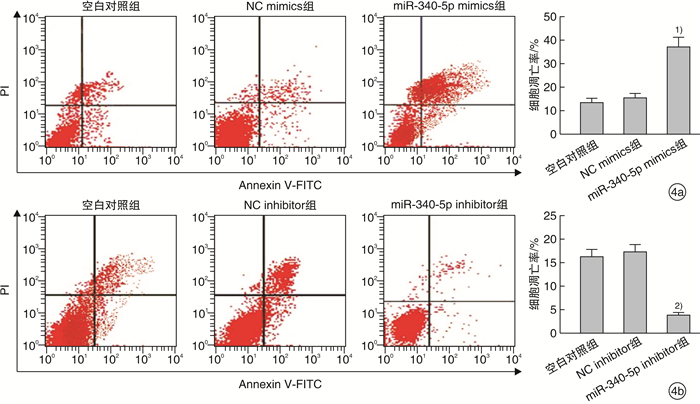
通过Annexin V/PI双染色法检测miR-340-5p mimics/inhibitor转染48 h后Hep2细胞的凋亡情况,过表达miR-340-5p后Hep2早晚期凋亡率显著高于NC mimics,而抑制miR-340-5p表达相比于NC inhibitor早晚期凋亡率显著降低,见图 4。
2.5 miR-340-5p调控喉癌病理分子机制
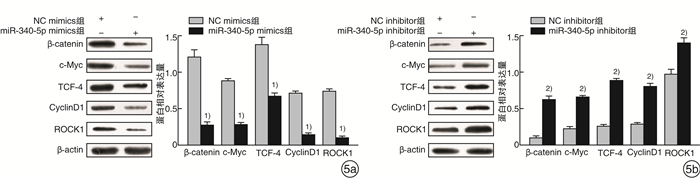
通过Western Blot检测miR-340-5p mimics/inhibitor转染后Hep2细胞中Wnt/β-catenin相关蛋白水平,结果如图 5所示:过表达miR-340-5p与NC mimics相比β-catenin、c-Myc、TCF-4、CyclinD1和ROCK1蛋白表达均显著降低,而抑制miR-340-5p表达较NC inhibitor,β-catenin、c-Myc、TCF-4、CyclinD1和ROCK1蛋白水平则显著升高。
3. 讨论
喉癌尤其是恶性喉鳞状细胞癌是人类头颈部最常见的肿瘤,其对放疗和化疗低敏,且预后不佳,发病率和死亡率极高,发病机制十分复杂,涉及到多种因素〔10〕。实际治疗中对喉癌发生、发展分子机制进行深入研究,寻找喉癌有效治疗靶点对于喉癌诊断、治疗及预后具有重要意义。
miRNAs与人类多种肿瘤的形成和发展密切关联,是一种新型调控分子,既可作为原癌基因又可作为抑癌基因,往往通过与靶基因结合从而实现对癌细胞的调控〔11〕。研究表明miR-206可抑制喉癌细胞增殖〔12〕,miR-29a-3p在喉癌患者体内表达降低,并且与肿瘤分期以及淋巴结的转移有关〔13〕。miR-340-5p也是在人体内正常细胞普遍存在的小RNA分子,其在多种肿瘤组织中异常低表达并参与癌症进程〔14〕,研究发现miR-340-5p的过表达可显著降低Bai3与DMD蛋白表达量〔15〕。STAT3是一种癌基因并在多种癌组织中高表达,其过表达与喉癌临床分期密切相关且可能是喉癌发生进展的主要决定因素〔16〕,研究证实多种miRNAs可与STAT3 3'-UTR靶向结合并通过调控信号通路影响癌细胞活性〔17〕,其中Wnt/β-catenin通路是细胞信号转导过程中重要的通路,β-catenin胞质积累并进入核内激活下游靶基因表达从而在细胞增殖、分化及肿瘤形成中起关键作用。
本研究发现miR-340-5p在喉癌患者组织和细胞中异常低表达,因此miR-340-5p的低表达可能与喉癌致病密切相关。通过在Hep2细胞中上调和下调miR-340-5p并分析其对Hep2细胞体外增殖、凋亡的影响,发现过表达miR-340-5p可显著抑制Hep2细胞体外增殖并诱导其发生凋亡,因此其在喉癌病理中是一种肿瘤抑制基因;通过验证STAT3是否为miR-340-5p潜在靶基因并检测Wnt/β-catenin通路相关蛋白水平,发现miR-340-5p直接与STAT3 3’-UTR相互作用且上调miR-340-5p水平可显著降低Hep2细胞内β-catenin、c-Myc、TCF-4、CyclinD1和ROCK1蛋白表达,这表明miR-340-5p可通过与靶基因STAT3结合从而靶向调控Wnt/β-catenin通路活性进而抑制Hep2细胞体外增殖并促进其凋亡。
综上所述,miR-340-5p在喉癌Hep2细胞中异常低表达,其通过靶向STAT3基因调控Wnt/β-catenin通路活性从而对喉癌细胞具有抑制效应,因此可作为以后喉癌临床诊断、治疗潜在的生物学靶标。
-
表 1 qRT-PCR及质粒构建引物序列
Primer Sequence(5'-3') STAT3-qF GGCCCAATGGAATCAGCTACAG STAT3-qR GAAGAAACTGCTTGATTCTTCG ACTB-F AGTCCTGTGGCATCCACGAAA ACTB-R GTCATACTCCTGCTTGCTGA STAT3-3' UTR-F ATCCGCTCGAGATGGCCCAATGGAATC STAT3-3' UTR-R CGACGCGTGAGGTCAACTCCATGTCAAAG -
[1] Anderson ME. Update on Survival in Osteosarcoma[J]. Orthop Clin North Am, 2016, 47: 283-292. doi: 10.1016/j.ocl.2015.08.022
[2] Nystrom LM, Reimer NB, Reith JD, et al. The Treatment and Outcomes of Extraskeletal Osteosarcoma: Institutional Experience and Review of The Literature[J]. Iowa Orthop J, 2016, 36: 98-103.
[3] Lee JA, Paik EK, Seo J, et al. Radiotherapy and gemcitabine-docetaxel chemotherapy in children and adolescents with unresectable recurrent or refractory osteosarcoma[J]. Jpn J Clin Oncol, 2016, 46: 138-143.
[4] Enokida H, Yoshino H, Matsushita R, et al. The role of microRNAs in bladder cancer[J]. Investig Clin Urol, 2016, 57 Suppl 1: S60-76. doi: 10.4111/icu.2016.57.S1.S60
[5] Li Z, Yu X, Shen J. Epub 2015 Oct 13. The role of miRNAs in the pheochromocytomas[J]. Tumour Biol, 2016, 37: 4235-4239. doi: 10.1007/s13277-015-4199-z
[6] Zhao P, Ma W, Hu Z, et al. Up-regulation of miR-340-5p promotes progression of thyroid cancer by inhibiting BMP4[J]. J Endocrinol Invest, 2018, 41: 1165-1172. doi: 10.1007/s40618-018-0848-6
[7] Zhang LL, Zhang LF, Shi Y B. miR-24 inhibited the killing effect of natural killer cells to colorectal cancer cells by downregulating Paxillin[J]. Biomed Pharmacother, 2018, 101: 257-263. doi: 10.1016/j.biopha.2018.02.024
[8] Wang DW, Wang YQ, Shu HS. MiR-16 inhibits pituitary adenoma cell proliferation via the suppression of ERK/MAPK signal pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22: 1241-1248.
[9] Alvanegh AG, Edalat H, Fallah P, et al. Decreased expression of miR-20a and miR-92a in the serum from sulfur mustard-exposed patients during the chronic phase of resulting illness[J]. Inhal Toxicol, 2015, 27: 682-688. doi: 10.3109/08958378.2015.1096982
[10] Spina A, Sorvillo L, Chiosi E, et al. Synergistic cytotoxic effects of inorganic phosphate and chemotherapeutic drugs on human osteosarcoma cells[J]. Oncol Rep, 2013, 29: 1689-1696. doi: 10.3892/or.2013.2306
[11] Singh R, Ramasubramanian B, Kanji S, et al. Circulating microRNAs in cancer: Hope or hype?[J]. Cancer Lett, 2016, 381: 113-121. doi: 10.1016/j.canlet.2016.07.002
[12] Long XH, Zhou YF, Peng AF, et al. Demethylation-mediated miR-129-5p up-regulation inhibits malignant phenotype of osteogenic osteosarcoma by targeting Homo sapiens valosin-containing protein(VCP)[J]. Tumour Biol, 2015, 36: 3799-3806. doi: 10.1007/s13277-014-3021-7
[13] Li C, Ma D, Yang J, et al. miR-202-5p inhibits the migration and invasion of osteosarcoma cells by targeting ROCK1[J]. Oncol Lett, 2018, 16: 829-834.
[14] Li G, Li L, Sun Q, et al. MicroRNA-3200-5p Promotes Osteosarcoma Cell Invasion via Suppression of BRMS1[J]. Mol Cells, 2018, 41: 523-531.
[15] Wozniak M, Sztiller-Sikorska M, Czyz M. Diminution of miR-340-5p levels is responsible for increased expression of ABCB5 in melanoma cells under oxygen-deprived conditions[J]. Exp Mol Pathol, 2015, 99: 707-716. doi: 10.1016/j.yexmp.2015.11.014
[16] Yan J, Wang Q, Zou K, et al. Inhibition of the JAK2/STAT3 signaling pathway exerts a therapeutic effect on osteosarcoma[J]. Mol Med Rep, 2015, 12: 498-502. doi: 10.3892/mmr.2015.3439
[17] Fan Y, Qian X, Zhang C. U/G SNP rs111904020 in 3'UTR of STAT3 regulated by miR-214 promotes hepatocellular carcinoma development in Chinese population[J]. Tumour Biol, 2016, 37: 14629-14635. doi: 10.1007/s13277-016-5352-z
期刊类型引用(4)
1. 曹宁,王文涛. miR-340对神经母细胞瘤细胞增殖、迁移的影响及其作用机制研究. 海南医学. 2023(02): 153-158 .  百度学术
百度学术
2. 周海婷,赵瑜,邱影. 喉癌组织中miR-340-5p、c-Myc、TCF-4的表达及临床意义. 中国医药导报. 2022(05): 110-114 .  百度学术
百度学术
3. 董雨,张山,武一平,祁红辉. 血肿周围脑组织miR-340-5p、PDCD4表达水平与高血压性脑出血病人预后的关系. 中国临床神经外科杂志. 2021(06): 422-425 .  百度学术
百度学术
4. 卜倩倩,高伟,吴勇延,郭培钰,王斌全. microRNA在喉鳞状细胞癌中的研究进展. 临床耳鼻咽喉头颈外科杂志. 2021(10): 947-951 .  本站查看
本站查看
其他类型引用(4)
-



 DownLoad:
DownLoad: